ইলেকট্রন বিন্যাস কাকে বলে?
কোন পরমাণুর বিভিন্ন শক্তিস্তরে কতটি ইলেকট্রন কিভাবে বিন্যস্ত আছে তার প্রকাশকে ইলেকট্রন বিন্যাস বলে।
অথবা,
একটি পরমাণুতে বিভিন্ন শক্তিস্তরে ইলেকট্রনগুলো কিভাবে সজ্জিত থাকে তার প্রকাশকে ইলেকট্রন বিন্যাস বলে।
অথবা,
নিউক্লিয়াসের চারপাশে বিভিন্ন শক্তিস্তরে শক্তির ক্রমানুসারে ইলেকট্রনগুলো যেভাবে সাজানো থাকে তাকে ইলেকট্রন বিন্যাস বলে।
অথবা,
কোন পরমাণুর বিভিন্ন শক্তিস্তরে কয়টি ইলেকট্রন কিভাবে আছে তার প্রকাশকে ইলেকট্রন বিন্যাস বলে।
কিছু মৌলের ইলেকট্রন বিন্যাস নিম্নরূপঃ
H(1): 1s1
He(2): 2s2
Li(3): 1s22s1
Be(4): 1s22s2
Na(11): 1s22s22p63s1
Ca(20): 1s22s22p63s23p64s2
পরমাণুর শক্তিস্তরে ইলেকট্রন বিন্যাস
বোরের মডেলে যে শস্তিস্তরের কথা বলা হয়েছে তাকে প্রধান শক্তিস্তর বলা হয়। প্রতিটি প্রধান শক্তিস্তরের সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতা 2n2 যেখানে n = 1, 2, 3, 4, . . . . ইত্যাদি।
অতএব, এ সূত্রানুসারে:
K শক্তিস্তরের জন্য n = 1; অতএব, K শক্তিস্তরে সর্বোচ্চ ইলেকট্রন থাকতে পারে, 2n2 = (2×12) টি = 2 টি
L শক্তিস্তরের জন্য n = 2; অতএব, L শক্তিস্তরে সর্বোচ্চ ইলেকট্রন থাকতে পারে, 2n2 = (2×22) টি = 8 টি
M শক্তিস্তরের জন্য n = 3; অতএব, M শক্তিস্তরে সর্বোচ্চ ইলেকট্রন থাকতে পারে, 2n2 = (2×32) টি = 18 টি
N শক্তিস্তরের জন্য n = 4; অতএব, N শক্তিস্তরে সর্বোচ্চ ইলেকট্রন থাকতে পারে, 2n2 = (2×42) টি = 32 টি
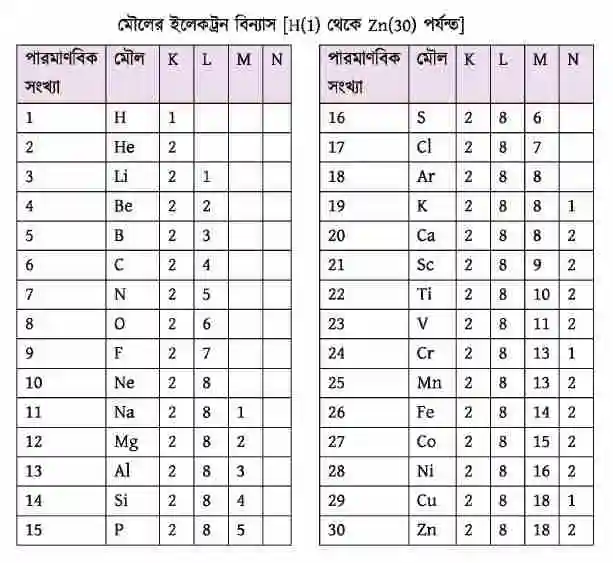
হাইড্রোজেন (H) পারমাণবিক সংখ্যা 1. ফলে এর ইলেকট্রন সংখ্যাও 1. তাই একটি ইলেকট্রন প্রথম শক্তিস্তর K-তে প্রবেশ করবে।
হিলিয়ামের (He) পারমাণবিক সংখ্যা 2. অতএব ইলেকট্রন দুটি প্রথম শক্তিস্তর K-তে প্রবেশ করবে। লিথিয়ামের (Li) পারমাণবিক সংখ্যা 3. ফলে প্রথম শক্তিস্তরে K-তে 2টি ইলেকট্রন প্রবেশ করবে।
যেহেতু K প্রধান শক্তিস্তরে দুটির বেশি ইলেকট্রন থাকতে পারে না তাই এর তৃতীয় ইলেকট্রনটি দ্বিতীয় শক্তিস্তর L তে প্রবেশ করবে।
আবার, সোডিয়াম (Na) এর পারমাণবিক সংখ্যা 11। তাই K শক্তিস্তরে 2টি, L প্রধান শক্তিস্তরে 8 টি। বাকি 1টি ইলেকট্রন M শক্তিস্তরে প্রবেশ করবে।
ইলেকট্রন বিন্যাস ভালোভাবে খেয়াল করলে দেখতে পাবে হাইড্রোজেন (H) থেকে আর্গন (Ar) পর্যন্ত উপরে যে নিয়ম বর্ণনা করা হয়েছে সেই নিয়মেই ইলেকট্রন বিন্যাস হয়েছে। কিন্তু নিয়মটি ব্যতিক্রম ঘটেছে পটাশিয়াম (K) থেকে পরবর্তী মৌলগুলোতে কেননা, আমরা জানি তৃতীয় শক্তিস্তর (M) এর সর্বোচ্চ ইলেকট্রন ধারণ ক্ষমতা 18 টি। কিন্তু পটাশিয়ামের 19 তম ইলেকট্রন এবং ক্যালসিয়ামের (Ca) 19তম ও 20তম ইলেকট্রন তৃতীয় শক্তিস্তর (M) কে অপূর্ণ রেখে আগেই চতুর্থ (N) শক্তিস্তরে প্রবেশ করে।
স্ক্যানডিয়ামের (Sc) ক্ষেত্রে 19তম ও 20তম ইলেকট্রন চতুর্থ শক্তিস্তরে যাবার পর 21তম ইলেকট্রনটি আবার তৃতীয় শক্তিস্তরে প্রবেশ করেছে। পারমাণবিক সংখ্যা 19 থেকে পরবর্তী মৌলগুলোতে আগে চতুর্থ প্রধান শক্তিস্তরে (N) দুটি ইলেকট্রন পূরণ করে তারপর ইলেকট্রন তৃতীয় প্রধান শক্তিস্তর M এ প্রবেশ করে। এরপরও Cr ও এর ইলেকট্রন বিন্যাসে বিশেষ ব্যতিক্রম লক্ষ করা যাচ্ছে। এই বিষয়টি বোঝার জন্য আমাদের উপশক্তিস্তরের ধারণাটি থাকতে হবে।
People’s Choice